Corrosione dei materiali metallici
Nel corso del loro impiego, i materiali metallici sono spesso in contatto con un mezzo aggressivo liquido oppure gassoso: la tendenza generale dei sistemi fisici a raggiungere lo stato termodinamicamente più stabile si manifesta attraverso il fenomeno della corrosione.
I processi di corrosione comportano la distruzione del materiale metallico e sono, quindi, di notevole importanza economica. I costi annuali attribuibili alla corrosione ed alle sue conseguenze sono valutabili in alcune migliaia di miliardi di lire nella maggior parte dei paesi industrializzati.
I due tipi principali di corrosione sono:
· La corrosione chimica: ad esempio la corrosione a secco in atmosfera ossidante ad alta temperatura.
· La corrosione elettrochimica: ad esempio la corrosione in ambiente marino.
In ogni caso, il fenomeno della corrosione è un problema di superficie o, più precisamente, di interfaccia fra un metallo ed un ambiente aggressivo liquido oppure gassoso.
In questo capitolo sarà considerata essenzialmente la corrosione elettrochimica in ambiente acquoso. Un approccio empirico permette di constatare che, qualora un metallo è messo in contatto con una soluzione aggressiva, si possono avere diversi fenomeni:
- corrosione del metallo;
- immunità del metallo;
- passività del metallo;
- copertura del metallo mediante un composto non metallico.
Per spiegare queste differenti possibilità, si devono esporre le basi della termodinamica e della cinetica elettrochimiche.
1. Termodinamica elettrochimica.
1.2. Tensione d’elettrodo all’equilibrio. Equazione di Nerst.
Un elettrodo è una fase, il più delle volte metallica, in contatto con un elettrolita.
L’insieme metallo-soluzione è spesso chiamato elettrodo per estensione.
Esempi:
1) Una lamina di rame in contatto con una soluzione di sale rameico costituisce un elettrodo;
2) Dell’idrogeno adsorbito su una lamina di platino in contatto con una soluzione acida costituisce un elettrodo;
3) Una struttura in acciaio immersa in acqua di mare costituisce un elettrodo.
Nei casi 1) e 2), che fanno intervenire un solo sistema elettrochimico (Cu/Cu+2 oppure H2/H+), si stabilisce spontaneamente una differenza di potenziale (d.d.p.)fra il metallo e la soluzione denominata tensione d’elettrodo all’equilibrio, che è caratteristica del sistema studiato.
Si può precisare questo punto con l’aiuto dell’elettrodo semplice costituito da una lamina del metallo M in contatto con una soluzione dei suoi sali Mz+. Tale elettrodo viene simbolizzato con M|Mz+ (figura 1).

Fig. 1
La messa in equilibrio del sistema comporta lo stabilizzarsi di un doppio strato elettrochimico assimilabile in prima approssimazione ad un condensatore carico. Questa separazione delle cariche in tale regione (globalmente
neutra) è associata ad una differenza di potenziale ai “limiti” del doppio strato (di spessore di alcuni nanometri). Questa differenza di potenziale jM - jS si chiama tensione assoluta dell’elettrodo: essa è dell’ordine del Volt.
Lo stato di equilibrio si descrive mediante l’equilibrio elettrochimico:
![]()
E’ fondamentale sottolineare che questo equilibrio corrisponde effettivamente all’esistenza simultanea di due reazioni aventi senso inverso, che avvengono con velocità uguali ed opposte. Il flusso di elettroni e
- che ne risulta corrisponde a due correnti elettriche uguali ed opposte la cui intensità I0 è l’intensità di corrente di scambio.L’equilibrio constatato è quindi il risultato dello stabilirsi di jM - jS ad un valore tale che i due flussi siano esattamente identici. All’equilibrio la corrente totale è nulla:
l’elettrodo è isolato.
In effetti, è impossibile misurare o calcolare le tensioni assolute d’elettrodo e si è costretti a misurarle con riferimento ad un elettrodo di riferimento , formando così una pila: si definisce in tale modo una tensione relativa di elettrodo.
L’elettrodo primario di riferimento è l’elettrodo ad idrogeno (Standard Hydrogen Electrode):
![]()
costituito da idrogeno gassoso alla pressione di 1 atmosfera , adsorbito su Platino in contatto con una soluzione acida di attività unitaria in ioni H
+ (in effetti H3O+). La tensione di elettrodo dell’elettrodo SHE è nulla per convenzione.In effetti l’elettrodo SHE è di impiego troppo delicato, e, per le misure pratiche, è normalmente sostituito da elettrodi di riferimento secondari: ad esempio l’elettrodo a calomelano saturato (SCE) ha una tensione di +0.2415 V/SHE.
Nel caso dell’elettrodo semplice M|Mz+ corrispondente all’equilibrio
![]()
la tensione d’elettrodo dipende dalla natura del sistema M|Mz+, dall’attività degli ioni Mz+ in soluzione e dalla temperatura.
La tensione d’elettrodo è data dalla equazione di Nerst. Denominando con e la tensione relativa di elettrodo, si ha:
![]()
·
![]() è l’attività degli ioni
è l’attività degli ioni
![]() in soluzione. L’attività è il prodotto della
molarità degli ioni [Mz+] per il
coefficiente di attività
in soluzione. L’attività è il prodotto della
molarità degli ioni [Mz+] per il
coefficiente di attività
![]() dipendente
dalla forza ionica della soluzione.
dipendente
dalla forza ionica della soluzione.
· R e F
sono rispettivamente la costante universale
![]() ed il Faraday (96500
C). T è la temperatura in Kelvin.
ed il Faraday (96500
C). T è la temperatura in Kelvin.
·
![]() è la tensione standard
d’elettrodo (corrispondente ad una attività unitaria).
è la tensione standard
d’elettrodo (corrispondente ad una attività unitaria).
Le tensioni standard dipendono solo dalla natura del sistema considerato. Esse sono generalmente reperibili in tabelle. Alcuni valori possono essere visti nella tabella seguente.

Generalizzazione: per un elettrodo per il quale si ha l’equilibrio
![]()
nel’equazione di Nerst si scrive
![]()
essendo unitarie le attività dei metalli puri e del solvente (acqua).
Esempio: per il sistema O
2/OH- (elettrodo ad ossigeno)1:

1.2. Previsione di reazioni elettrochimiche.
Si
consideri la cella galvanica
![]() schematizzata
nella figura 2 .
schematizzata
nella figura 2 .

Fig. 2
· La misura della f.e.m. E (a corrente nulla), ottenuta utilizzando un voltmetro ad elevata impedenza, mostra che la polarità è quella indicata (figura 2a): l’elettrodo Zn (-), l’elettrodo Cu (+). Trascurando le tensione di giunzione delle connessioni metalliche e soluzione-soluzione, si può scrivere:

· Se i due elettrodi sono collegati mediante una resistenza (figura 2b), un flusso di elettroni va dallo zinco al rame, ed è misurabile una corrente I che va dal rame allo zinco.
All’elettrodo di Zn ha luogo la reazione
![]()
All’elettrodo di Cu ha luogo la reazione
![]()
Globalmente si ottiene
![]()
con il rame che si riduce e lo zinco che si ossida.
· L’elettrodo di zinco, ove ha luogo una ossidazione, è un anodo.
· L’elettrodo di rame, ove ha luogo una riduzione, è un catodo.
L’anodo
di zinco è progressivamente messo in soluzione sotto forma di ioni
![]() e subisce un fenomeno di corrosione
che appare quindi sotto forma di ossidazione del metallo. Tale ossidazione è
possibile in quanto:
e subisce un fenomeno di corrosione
che appare quindi sotto forma di ossidazione del metallo. Tale ossidazione è
possibile in quanto:
![]()
Il confronto delle tensioni di elettrodo dei due sistemi redox permette quindi la previsione delle reazioni elettrochimiche.
1.3. Condizione termodinamica della corrosione metallica.
Se si suppone che la resistenza R
e tende ad annullarsi, la cella galvanica è in corto circuito, e V tende anch’esso ad annullarsi. Questa condizione è, ad esempio, ottenuta considerando un sistema metallico costituito da un pezzo di zinco in contatto con un pezzo di rame, immersi in una soluzione contenente Cu2+ e Zn2+. I fenomeni restano qualitativamente gli stessi descritti precedentemente:- lo zinco va in soluzione sotto forma di ioni Zn2+ e costituisce l’anodo del sistema;
- il rame si deposita sul catodo di rame.
Gli elettroni vanno dallo zinco al rame all’interno della massa metallica (figura 3).


Fig. 3 Fig. 4
Una situazione analoga è rappresentata sulla figura 4 ove delle “inclusioni” di rame sono contenute in una matrice di zinco.
Un sistema metallo-elettrolita in cui si sta sviluppando un fenomeno corrosivo appare quindi come una cella galvanica in corto circuito: le zone anodiche si corrodono ed il metallo subisce una ossidazione. La massa metallica è equipotenziale e, se si può trascurare la caduta ohmica nell’elettrolita, le zone anodiche e catodiche sono caratterizzate da una tensione d’elettrodo comune denominata tensione di corrosione.
Non si deve confondere la tensione d’equilibrio di un elettrodo semplice (equazione di Nerst) e la tensione di corrosione. Un elettrodo complesso in cui si stanno verificando fenomeni di corrosione è la sede di fenomeni irreversibili che non possono essere descritti mediante la termodinamica dei sistemi all’equilibrio.
Negli esempi precedenti le aree anodiche e catodiche sono nettamente distinte: la corrosione è la conseguenza della formazione di pile localizzate. L’esistenza di tali micro o macro pile può essere dovuta a differenze di composizione chimica delle diverse zone del metallo, a differenze di composizione delle diverse zone dell’elettrolita, a delle differenze nelle sollecitazioni fra le diverse parti del metallo, etc., ed in generale è
dovuta alla formazione di eterogeneità.
La teoria delle pile localizzate implica una corrosione eterogenea, ma non permette di affrontare il problema della corrosione nei materiali omogenei.
Si può generalizzare tale teoria dicendo che la condizione necessaria perché un metallo si corroda (sistema fornitore di elettroni), è che esista un sistema accettore di elettroni in grado di scambiare elettroni con tale metallo. Tali sistemi accettori esistono in generale negli elettroliti. Nel caso delle soluzioni acquose i più importanti sono:
· La riduzione dei protoni:
![]()
· La riduzione dell’ossigeno disciolto
![]()
Questo tipo di corrosione non necessita della presenza di aree anodiche e catodiche localizzate. Si può ammettere che queste zone in effetti esistono, ma sono distribuite a caso nel tempo e nello spazio su tutta la superficie del metallo, causando in tale modo la corrosione omogenea.
Riassumendo ciò che è stato detto precedentemente, perché il sistema accettore (sottoposto a riduzione) possa scambiare degli elettroni con il sistema donatore (sottoposto ad ossidazione), è necessario che la sua tensione di equilibrio sia superiore:
![]()
![]() : tensione di equilibrio (a corrente
nulla) del sistema accettore
: tensione di equilibrio (a corrente
nulla) del sistema accettore
![]() : tensione di equilibrio del
sistema donatore (metallo).
: tensione di equilibrio del
sistema donatore (metallo).
Ad
esempio, per una lamina in ferro in contatto con una soluzione acida (a pH = 1),
di attività ![]() , il sistema donatore che può
essere preso in considerazione è:
, il sistema donatore che può
essere preso in considerazione è:
![]()
Il sistema accettore che può essere preso in considerazione è:

(considerando pH2 = 1 atm, pressione di formazione delle bolle di gas).
Quindi in
tale caso
![]() , e la corrosione è termodinamicamente
possibile ed avverrà secondo la reazione:
, e la corrosione è termodinamicamente
possibile ed avverrà secondo la reazione:
![]()
Il ferro si corrode uniformemente sotto forma di ioni Fe2+ che entrano in soluzione, con la formazione di bolle di idrogeno sulla placca metallica.
E’
importante sottolineare che la condizione
![]() permette solo di dire se la corrosione
è possibile o impossibile nelle condizioni sperimentali precisate. Essa
non da alcuna informazione sulla velocità con cui il fenomeno della corrosione
avviene.
permette solo di dire se la corrosione
è possibile o impossibile nelle condizioni sperimentali precisate. Essa
non da alcuna informazione sulla velocità con cui il fenomeno della corrosione
avviene.
1.4. Influenza del pH. Diagrammi e(pH) o di Pourbaix.
La condizione
![]() può evolvere quantitativamente in
funzione della variazione dei parametri esterni: pH, presenza di ioni
complessanti, presenza di microrganismi, etc. .
può evolvere quantitativamente in
funzione della variazione dei parametri esterni: pH, presenza di ioni
complessanti, presenza di microrganismi, etc. .
Fra questi fattori, il pH gioca un ruolo particolarmente importante.
Esso può intervenire per due ragioni:
- si ha
una influenza sulla reazione accettrice, dunque su
![]() ;
;
- si ha
una influenza sulla reazione donatrice (ossidazione), dunque su
![]() .
.
Il
diagramma di Pourbaix di un sistema è la rappresentazione isotermica della
evoluzione ![]() per una
composizione determinata, cioè con concentrazioni molari delle specie ioniche in
soluzione fissate: è normale
per una
composizione determinata, cioè con concentrazioni molari delle specie ioniche in
soluzione fissate: è normale
scegliere 10-6 mol/l per le specie ioniche nei problemi di corrosione (a meno che esse abbiano dei valori
sperimentali noti).
La figura 5 rappresenta il diagramma di Pourbaix del ferro tracciato per una concentrazione molare delle
specie in
soluzione di 10-6
mol/l, limitato alle specie
![]()
![]()

Fig. 5
Nella figura sono evidenti dei domini in cui le differenti specie sono preponderanti, limitate da linee di confine che rappresentano i differenti equilibri possibili.
Ad esempio:
- la frontiera ab corrisponde all’equilibrio:
![]()
cui
![]()
indipendentemente dal pH.
Se si impone alla lamina di ferro una tensione superiore a - 0.62 V. essa si ossiderà in ioni Fe
2+. Se si imporrà una tensione inferiore, degli ioni Fe2+ saranno ridotti e la concentrazione molare diventerà inferiore a 10-6 mol/l.- la
frontiera bc corrisponde all’equilibrio
![]()
cui
![]() .
.
In questo caso la tensione di equilibrio decresce linearmente con il pH.
Le altre frontiere sono interpretabili in maniera analoga.
Nella figura 5 è stato inoltre sovrapposto il dominio di stabilità dell’acqua, delimitato dalle seguenti frontiere:
![]() corrispondenti
rispettivamente agli equilibri:
corrispondenti
rispettivamente agli equilibri:
![]()
· per
![]() il ferro è ossidabile dagli ioni H
il ferro è ossidabile dagli ioni H
· per
![]() il ferro è ossidabile dall’ossigeno
disciolto. In effetti in un ambiente acido questa reazione
il ferro è ossidabile dall’ossigeno
disciolto. In effetti in un ambiente acido questa reazione
non
interviene nonostante
![]()
![]() . La sua cinetica è, in queste
condizioni, quasi nulla.
. La sua cinetica è, in queste
condizioni, quasi nulla.
Quindi,
si possono determinare nel piano
![]() i seguenti domini
(figura 6):
i seguenti domini
(figura 6):
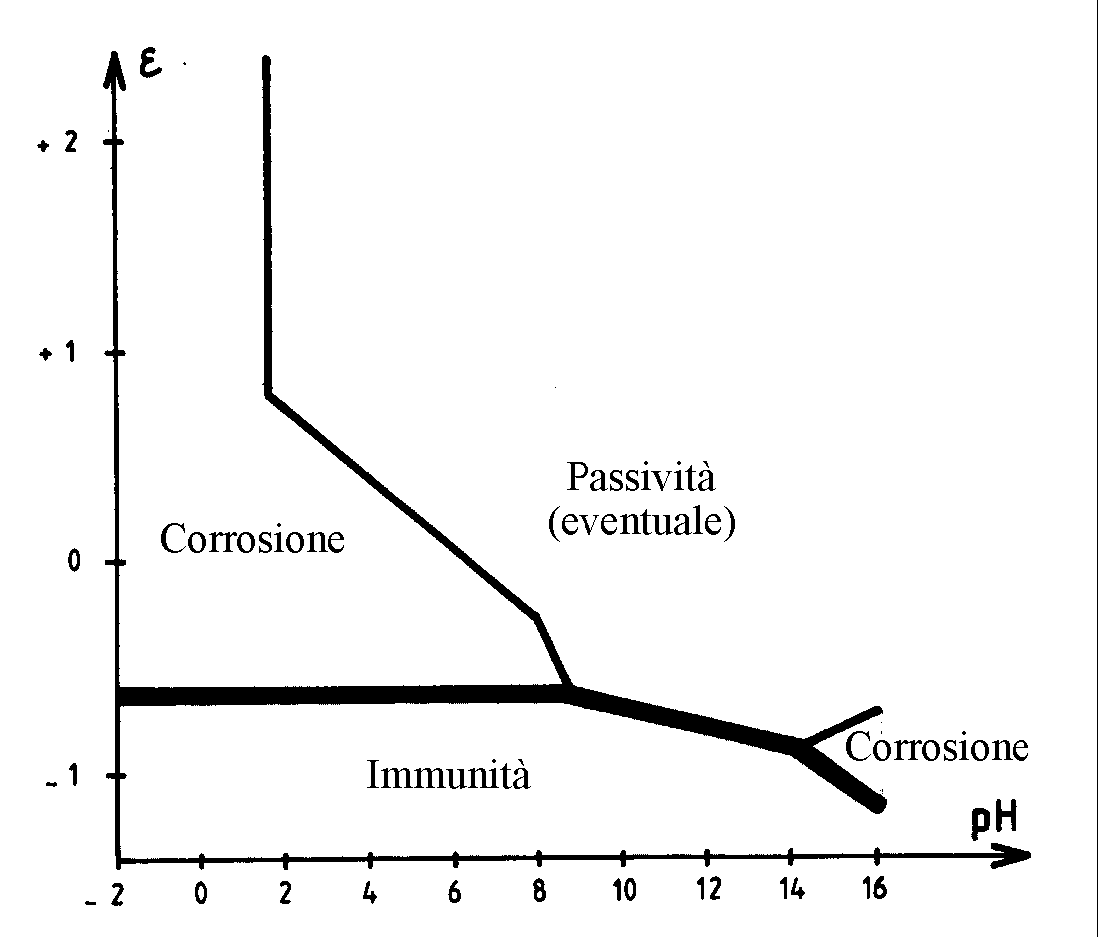
Fig. 6
- un dominio di corrosione,
in cui le forme di corrosione sono gli ioni
- un
dominio di passività eventuale, in cui le forme di ossidazione del metallo
sono gli ossidi ![]() , che
possono essere protettori;
, che
possono essere protettori;
- un dominio di immunità, in cui si il metallo stabile, o, meglio, in cui la concentrazione molare degli ioni è inferiore a 10-6 mol/l.
Privacy Policy - Personalizza tracciamento pubblicitario